Alzheimer : des mystères et de nouvelles pistes
Cet article est issu de L'Édition n°21.
La maladie d’Alzheimer est une pathologie neurodégénérative touchant aujourd’hui près d’un million de Françaises et de Français, d’après l’Institut du Cerveau. Cette maladie, dont le facteur de risque le plus important est l’âge, est la principale cause de démence dans le monde, d’après l’Organisation mondiale de la santé (OMS). Développement, diagnostic et traitement : tous les angles de recherche possibles concernant la maladie sont étudiés par les scientifiques de l’Université Paris-Saclay.
Aujourd’hui, l’OMS dénombre près de 36 millions de personnes atteintes de la maladie d’Alzheimer, un chiffre amené à potentiellement tripler d’ici 2050. En France, d’après une étude de l’Inserm et de l’Université de Bordeaux, deux millions de personnes en seraient atteintes en 2040, soit plus du double des patientes et patients actuellement recensés. « C’est une maladie possédant une prévalence et une incidence très importantes », résume Yvette Akwa, chercheuse au laboratoire Maladies et hormones du système nerveux (DHNS – Univ. Paris-Saclay, Inserm). « Le facteur de risque principal de la maladie d’Alzheimer est l’âge. Étant donné que nous vivons plus longtemps, le nombre de cas va croître dans les années futures, poursuit la chercheuse. En revanche, l’âge n’est pas le seul facteur de risque : les femmes sont plus fortement touchées (60 % des patients français sont des femmes, d’après l’Inserm) en raison de la chute des oestrogènes à la ménopause. L’hérédité, un taux élevé de cholestérol et des agents environnementaux (consommation de tabac, d’alcool, dépression, etc.) sont les autres facteurs de risques notables. »
Que sait-on de la maladie d’Alzheimer ?
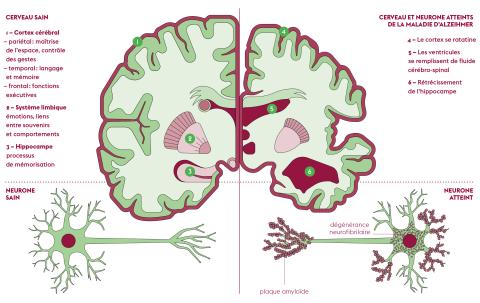
Découverte par Aloïs Alzheimer en 1907, la maladie portant désormais le nom du psychiatre allemand se définit par deux types de lésions touchant le cerveau, causées chacune par une protéine spécifique : les plaques amyloïdes, ou « séniles », sont dues au peptide bêta-amyloïde et la dégénérescence neurofibrillaire est liée à l’hyperphosphorylation de la protéine Tau. Ces deux lésions se développent en premier lieu dans la région cérébrale de l’hippocampe, siège de la mémoire. Découle de cette localisation spécifique le symptôme principal de la maladie d’Alzheimer : la perte de mémoire.
S’il fallait retracer les origines de la maladie, la protéine précurseur de l’amyloïde (APP) serait proche du sommet de l’arbre généalogique. « Comme son nom l’indique, l’APP est le précurseur de l’amyloïde, dont l’accumulation dans le cerveau est à l’origine des plaques séniles. Selon la façon dont il est coupé par des enzymes, il est à l’origine de deux voies : une voie physiologique prédominante et non-amyloïdergique, et une autre voie, dont on n’explique pas l’existence, à l’origine notamment des bêta-amyloïdes Aβ40 et Aβ42. C’est cette dernière voie qui est pathologique, abonde Yvette Akwa. Autrement, l’APP a un rôle tout à fait bénéfique : la protéine, dont le gène est situé sur le chromosome 21, favorise la survie neuronale, la genèse des synapses et les capacités de mémoire. Au même titre que les mutations génétiques, on n’explique pas vraiment pourquoi certaines enzymes coupent l’APP de manière spécifique pour produire les peptides bêta-amyloïdes. »
Les peptides Aβ40 et Aβ42, issus du clivage de l’APP, s’agrègent de manière progressive et en premier lieu dans le lobe temporal du cerveau, près de l’hippocampe, avant d’atteindre l’ensemble du cerveau. En parallèle à cette accumulation croissante à l’extérieur des neurones, la dégénérescence neurofibrillaire frappe l’intérieur des cellules nerveuses, par l’hyperphosphorylation de la protéine Tau. En temps normal, la phosphorylation est un mécanisme naturel de modification de la conformation d’une protéine, par l’addition d’un groupe phosphate sur un ou plusieurs acides aminés de la protéine, modifiant ainsi son activité. « La protéine Tau favorise la polymérisation de la tubuline en microtubules, dans le transport de divers composants dans le neurone. Tau possède de nombreux sites de phosphorylation, détaille Yvette Akwa. En fait, dès que la protéine Tau est hyperphosphorylée, elle se dissocie des microtubules (qui vont alors se désintégrer), tombe dans le cytoplasme et s’agrège progressivement, pour former la neurodégénérescence fibrillaire, entraînant la mort des neurones. »
Ce double mécanisme lésionnel caractérisant la maladie d’Alzheimer est très lent et se développe généralement durant plusieurs décennies avant l’apparition des premiers symptômes, incluant troubles de la mémoire (amnésie), du langage (aphasie), du mouvement (apraxie), etc.
Les cellules gliales, l’imagerie et l’identification anticipée de la pathologie
Le Laboratoire des maladies neurodégénératives (LMN – Univ. Paris-Saclay, CEA, CNRS) étudie de manière fondamentale et mécanistique trois grandes maladies neurodégénératives : Alzheimer, Parkinson et Huntington. « L’originalité du LMN réside dans notre manière transversale d’aborder la problématique, avec à la fois des études sur les mécanismes fondamentaux, les interactions cellulaires et leur comportement, et l’utilisation de techniques d’imagerie cérébrale », développe Gilles Bonvento, directeur du laboratoire. Au sein du LMN, un intérêt tout particulier est porté aux cellules gliales, composant environ la moitié du cerveau et rarement étudiées dans le cadre des maladies neurodégénératives.
En effet, comme leur nom l’indique, ces maladies ont pour conséquence la mort des neurones, et la recherche s’est longtemps concentrée sur leur fonctionnement et les mécanismes en lien avec les pathologies neurodégénératives. « Nous nous sommes aperçus tardivement que, concernant par exemple la maladie d’Alzheimer, nous n’étions pas face à une maladie dite “cellule-autonome”, ne concernant que les neurones. Finalement, la mort du neurone est un phénomène très tardif dans l’évolution de la maladie, abonde Gilles Bonvento. Les défaillances des circuits rendant compte des symptômes cliniques sont elles-mêmes précédées par des processus cellulaires cliniquement silencieux et à progression lente, au moins 20 ans avant la mort des neurones. Nous étudions désormais ces évènements antérieurs à la mort neuronale, en intégrant de nouvelles cellules, comme les cellules gliales, à la recherche. »
Divisées en trois catégories (les astrocytes, les microglies et les oligodendrocytes), les cellules gliales promeuvent la communication entre les neurones. « Les neurones sont au coeur de l’activité du cerveau, mais l’évolution les a rendus très vulnérables. Ils nécessitent beaucoup de cellules de support pour bien fonctionner, détaille Gilles Bonvento. Notre stock de neurones à la naissance ne fait que diminuer au cours de notre existence. Les cellules gliales ne sont pas aussi sensibles et vulnérables au temps. »
Au LMN, une équipe dédiée travaille sur la contribution des cellules gliales à la physiopathologie de la maladie d’Alzheimer. Elle s’intéresse notamment à un type de cellule gliale en particulier : les astrocytes. Une équipe, menée par Caroline Escartin, étudie par exemple les interactions entre astrocytes et neurones et le changement phénotypique de ces astrocytes. « Cela ouvre la possibilité d’identifier de nouveaux biomarqueurs de la maladie, ajoute Gilles Bonvento. C’est essentiel de détecter la maladie au plus tôt. On sait aujourd’hui que les dysfonctionnements apparaissent bien avant les premiers symptômes (troubles de mémoire, d’orientation ou autres troubles cognitifs). Notre but est d’avoir des biomarqueurs aux stades les plus précoces possibles de la maladie d’Alzheimer pour identifier et mettre en évidence des personnes sur une trajectoire qui les mènera à cette maladie. »
Le LMN profite par ailleurs de son installation au sein du Molecular imaging research center (MIRCen – Univ. Paris Saclay, CEA), situé au centre CEA à Fontenay-aux-Roses et récemment doté d’un accélérateur de particules, le cyclotron, et d’une plateforme d’imagerie de tomographie par émission de positons (TEP) et d’imagerie par résonance magnétique (IRM). « Le cyclotron est essentiel à la synthèse sur place de radioligands, qui nous aideront notamment à identifier des biomarqueurs de la maladie d’Alzheimer par imagerie TEP. Le développement d’outils d’imagerie pour suivre l’évolution de la pathologie de façon atraumatique est un des axes principaux de recherche du LMN, avance Gilles Bonvento. Aujourd’hui, le suivi de la pathologie et son diagnostic doivent associer des batteries de tests cognitifs à d’autres examens. Nous développons d’un côté des ligands d’intérêt pour le suivi de la maladie, et de l’autre de nouvelles approches par IRM, afin d’objectiver des modifications fonctionnelles du cerveau. Cet axe s’appuie sur plusieurs modalités d’imagerie comme la spectroscopie par résonance magnétique nucléaire (SRM). »
Véritable « biopsie virtuelle », la SRM donne aux chercheurs et chercheuses des informations sur les taux cérébraux de nombreux indicateurs clés (acides aminés, comme le glutamate, etc.). Julien Valette, directeur-adjoint du LMN, et son équipe ont également développé de nouvelles méthodes de spectroscopie visant à quantifier certaines caractéristiques morphologiques des neurones et astrocytes. Mais elle n’est pas une solution unique. « Avec la maladie d’Alzheimer, toute la difficulté est d’être sensible aux évènements précoces et sélectif. Finalement, nous cherchons à élaborer un faisceau d’arguments pertinents pour caractériser la maladie au plus tôt. Il sera vraisemblablement difficile de dire en un seul examen par spectroscopie RMN si un patient ou une patiente est atteinte de la maladie. En revanche, la RMN apporte des arguments supplémentaires, qui ensuite convergent avec les tests cliniques, l’imagerie TEP, dans le but de poser un diagnostic définitif et surtout pour suivre l’efficacité des thérapies. »
Les stéroïdes sulfatés comme traitement ?
Au sein du DHNS, Yvette Akwa s’intéresse à la prégnénolone, le principal précurseur des neurostéroïdes, les stéroïdes synthétisés dans le système nerveux à partir de cholestérol. « Je me suis d’abord intéressée à la biosynthèse et au métabolisme des neurostéroïdes dans le cerveau du rat », raconte la chercheuse. Dans l’organisme, la prégnénolone est notamment convertie en sulfate de prégnénolone. D’autre part, il est établi que cette molécule sulfatée stimule les récepteurs glutamatergiques N-méthyl- D-aspartate (NMDA) présents au niveau des synapses, l’interface entre deux neurones assurant la transmission d’informations entre eux. Les récepteurs NMDA sont essentiels à la mémorisation et à la capacité du système nerveux de faire et défaire de nouvelles connexions entre neurones : la plasticité synaptique.
En outre, des effets positifs du sulfate de prégnénolone ont été observés sur la mémoire. « J’ai montré que le sulfate de prégnénolone était promnésiant, qu’il favorisait les performances mémoire spatiale, chez l’animal (souris et rats) jeune, et antiamnésiant chez des animaux âgés entre 12 et 21 mois. C’est à partir de ces découvertes que je me suis intéressée à la maladie d’Alzheimer, le sulfate de prégnénolone étant capable de stimuler la mémoire et d’inverser la perte de mémoire chez des animaux non atteints par la maladie », poursuit Yvette Akwa. Or, d’après ses études, le taux de sulfate de prégnénolone diminue avec l’âge, et plus rapidement encore lorsque les sujets sont touchés par la maladie d’Alzheimer. « Nous avons quantifié les taux de neurostéroïdes dans des échantillons de différentes régions du cerveau de patients âgés atteints ou non de la maladie. On observe que ces taux diminuent significativement dans le cerveau des patients atteints par la maladie, comparé à des personnes non-atteintes. Mais le plus important est ailleurs : la baisse de la quantité de sulfate de prégnénolone dans le cerveau est corrélée aux taux élevés des dépôts amyloïdes. Grâce à d’autres études, nous avons montré que ce neurostéroïde avait un rôle protecteur du neurone et qu’il corrigeait les symptômes dus au peptide bêta-amyloïde. Dernièrement, nous avons également observé une diminution de protéines Tau hyperphosphorylées », avance Yvette Akwa. Deux objectifs se dressent devant la chercheuse : réussir à éliminer les agrégats liés au dérèglement de la protéine Tau ou des bêta-amyloïdes, et, quête tout autant importante, diminuer voire empêcher l’hyperphosphorylation de Tau. Car sans cette phosphorylation anormale, la protéine ne se dépose pas dans le cytoplasme de la cellule et ne forme pas d’agrégats. « J’ai l’espoir que des composés comme le sulfate de prégnénolone puissent à la fois diminuer la neurotoxicité due à l’amyloïde et celle due à Tau, et surtout restaurer la mémoire. Nous lutterions ainsi contre un véritable combiné des trois aspects essentiels de la maladie d’Alzheimer », décrit Yvette Akwa.
Favoriser les interactions entre transthyrétine et peptide bêta-amyloïde
Au sein du laboratoire Biomolécules : conception, isolement, synthèse (BioCIS – Univ. Paris- Saclay, CNRS, CY Cergy Paris Univ.), Nicolo Tonali s’intéresse tout particulièrement à l’agrégation du peptide bêta-amyloïde Aβ42 dans le cerveau. Le but de ses recherches est d’éviter la formation de ces espèces fibrillaires, et de faciliter la dégradation physiologique du peptide. « Dans les plaques amyloïdes, on retrouve différentes protéines comme la transthyrétine (TTR), dont le rôle dans le sang est notamment celui du transport d’hormones. Nous avons constaté qu’il existait une myriade d’interactions positives entre la TTR et Aβ42 : réduction des agrégats, de leur toxicité, dégradation et dissociation des agrégats déjà formés, etc. », développe Nicolo Tonali.
Depuis ces premières découvertes datant de 2021, le chercheur et nombre de ses collègues ont développé une stratégie pour réunir TTR et Aβ42. Basée sur la protéolyse médiée, la stratégie PROTAC (Proteolysis trageting chimeric) consiste à forcer le regroupement de deux protéines – ici, Aβ42 et la TTR – dans le but de maximiser leurs interactions et d’éventuellement favoriser l’élimination du peptide amyloïde. « Nous avons observé une bonne interaction entre TTR et une portion de Aβ42 par médiation du cuivre, métal d’ailleurs fortement présent dans le cerveau des patientes et patients atteints de la maladie d’Alzheimer. Nous souhaitons construire une molécule dotée d’un liant peptidique étant à la fois capable d’aller chercher la TTR, de la placer au contact d’Aβ42, et que le rôle physiologique de la première protéine agisse sur la seconde. Le groupement final est ensuite évacué », présente le chercheur.
La maladie d’Alzheimer demeure une thématique de recherche riche et passionnante, notamment en raison des nombreux mystères qui l’entourent encore. Mais grâce à de nouveaux outils, il devient possible de mieux l’appréhender, avec l’espoir de la détecter au plus tôt et de développer des solutions thérapeutiques.
Publications :
- Akwa Y., Steroids and Alzheimer’s Disease: Changes Associated with Pathology and Therapeutic Potential, Int. J. Mol. Sci. 2020.
- Bonvento G., Glycolysis-derived L-serine in hippocampal astrocytes rescues synaptic plasticity and memory loss in a mouse model of Alzheimer’s disease. Alzheimer’s Dement., 2022.
- Tonali N., et al., Application of PROTAC strategy to TTR-Aβ protein-protein interaction for the development of Alzheimer’s disease drugs. Neural regeneration research, 2021.