La chimiothérapie sous-cutanée, une solution pour alléger le traitement du cancer ?
Avec dix millions de décès chaque année, le cancer est l’une des principales causes de mortalité dans le monde. Si des traitements existent, comme la chimiothérapie, ils sont souvent la source d’effets secondaires très douloureux pour les malades et de nombreuses contraintes logistiques. Des chercheurs et chercheuses de l’Université Paris-Saclay ont développé une nouvelle chimiothérapie administrable par voie sous-cutanée. Objectif : rendre cette thérapie plus confortable et plus efficace et, ainsi, révolutionner le traitement contre le cancer.
Le cancer est la première cause de mortalité prématurée en France. Chaque année, près de 400 000 nouveaux cas sont en moyenne recensés sur le territoire français, et on dénombre plus de 150 000 décès liés au cancer sur cette même période. Dans le monde, ce sont plus de dix-huit millions de cas détectés par an, pour près de dix millions de morts. Des chiffres qui expliquent à eux seuls les efforts de recherche entrepris contre cette maladie.
Le cancer se caractérise par la prolifération démesurée et anarchique de cellules dont l’ADN, support de l’information génétique, présente certaines mutations. Cet amas incontrôlé forme alors une tumeur maligne. Mais il existe en réalité une multitude de cancers, nommés selon la localisation originelle de la première tumeur. Actuellement, de nombreuses thérapies existent pour lutter contre les cancers. L’exérèse, opération chirurgicale consistant à retirer la tumeur, est la méthode privilégiée. Lorsque cette dernière n’est plus prescriptible, quand les tumeurs sont par exemple trop nombreuses, la radiothérapie et la chimiothérapie s’imposent. Ces deux traitements reposent respectivement sur l’utilisation de rayons ionisants et l’administration de différents principes actifs dans le but de détruire les cellules cancéreuses.
Parmi toutes les thérapies contre le cancer, la chimiothérapie est sûrement la plus invasive. Celle-ci consiste, dans la grande majorité des cas, en une injection intraveineuse par voie centrale (c’est-à-dire directement dans une veine de gros calibre) durant de longues séances à l’hôpital. C’est un traitement douloureux, long, coûteux et contraignant, tant pour les patientes et patients que pour le personnel médical. Nombre des principes actifs utilisés dans le cadre d’une chimiothérapie sont également irritants et vésicants (provoquent des lésions au niveau des tissus) ; des effets secondaires comme la chute de cheveux ou des toxicités (hématologiques, cardiaques ou neurologiques) sont également observés chez les personnes au cours de leur traitement.
Neutraliser le caractère irritant et vésicant de la chimiothérapie
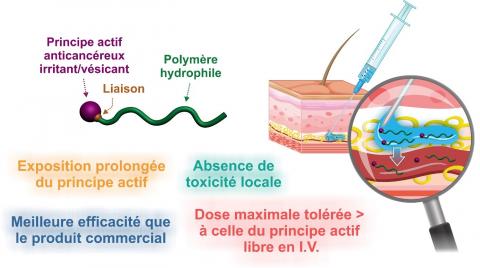
Au sein de l’Institut Galien Paris-Saclay (IGPS – Univ. Paris-Saclay, CNRS), en collaboration avec le CEA Paris-Saclay et la fédération des laboratoires d'analyses vétérinaires d'Oniris (LabOniris), les chercheurs et chercheuses des équipes Nanomédicaments pour le traitement de maladies graves et Ingénierie particulaire et cellulaire à visée thérapeutique souhaitent repenser la chimiothérapie et son approche. Pour ce faire, elles et ils se sont donnés comme objectif de passer outre la voie intraveineuse afin de privilégier l’administration directement sous la peau (sous-cutanée), d’une prodrogue de leur confection, un nanomédicament composé d’un polymère soluble dans l’eau lié à une molécule anticancéreuse.
Ce couplage a l’avantage de neutraliser la toxicité du principe actif durant sa migration dans le tissu sous-cutané jusqu’au système sanguin, où différentes enzymes couperont alors la liaison entre polymère et principe actif. « La plupart des molécules anticancéreuses sont irritantes et vésicantes. Et la plupart d’entre elles sont également hydrophobes, ce qui engendre une stagnation sous-cutanée du médicament. En liant le principe actif à un polymère hydrophile par une liaison covalente, l’ensemble devient soluble, et le caractère irritant et vésicant des prodrogues "s’éteint" temporairement », détaille Julien Nicolas, directeur de recherche au CNRS à l’IGPS.
La prodrogue conçue par les membres de l’équipe se compose de polyacrylamide et de paclitaxel (Taxol®), une molécule anticancéreuse hydrophobe très vésicante et couramment utilisée pour traiter différents types de cancer. « Schématiquement, on a fait "pousser" le polyacrylamide à partir du paclitaxel. Le concept en lui-même est d’ailleurs plutôt intéressant », souligne Julien Nicolas. Grâce à cette technique de synthèse, les scientifiques de l’IGPS contrôlent la longueur du polymère et la nature de la liaison avec le principe actif. « Nous avons choisi ce polymère spécifiquement pour ses caractéristiques biocompatible et hydrophile. Dès lors que le polymère a atteint une certaine longueur, on obtient une prodrogue soluble dans l’eau, ce qui permet de l’injecter en sous-cutané, sans observer ni stagnations, ni lésions de la peau ou au niveau du tissu sous-cutané. Pour cela, il faut disposer d’une liaison paclitaxel-polymère suffisamment robuste pour éviter tout relargage précoce du principe actif, mais suffisamment fragile pour être coupée par les enzymes du système sanguin », détaille le chimiste. Une fois la liaison rompue, le polyacrylamide est éliminé par filtration rénale.
Outre le paclitaxel, les membres de l’équipe ont d’ores et déjà testé leur méthodologie sur d’autres molécules anticancéreuses. « Du point de vue de la synthèse, notre procédé est adaptable, avec assez de polyvalence, à d’autres principes actifs, hydrophiles comme hydrophobes. Il suffit simplement de les modifier pour y permettre la croissance du polymère », ajoute Julien Nicolas.
Une administration moins douloureuse… et plus efficace ?
Comparée aux méthodes standards d’injection par intraveineuse, l’administration d’une chimiothérapie par voie sous-cutanée est plus confortable pour les patientes et patients, nécessite un personnel médical restreint tout au long du traitement, et s’avérerait également plus efficace pour lutter contre les tumeurs, d’après Julien Nicolas. « Le polyacrylamide possède des propriétés de furtivité vis-à-vis du système immunitaire. De ce fait, la prodrogue possède un temps de résidence prolongé dans la circulation sanguine et agit comme un réservoir de paclitaxel. En effet, nous nous sommes rendu compte que la molécule est libérée progressivement dans le sang. Et ceci représente un avantage. »
Alors, étant donné le caractère graduel avec lequel le principe actif est délivré, il est envisageable de voir augmenté le temps d’exposition des patientes et patients à leur chimiothérapie, tout en diminuant drastiquement les effets secondaires, comme l’explique Julien Nicolas. « Le polymère va en effet passer un certain temps dans le système sanguin, avant d’être éliminé naturellement. La concentration maximale du principe actif dans le corps est à l’origine de la plupart des effets secondaires indésirables. Grâce à l’injection sous-cutanée de nos prodrogues, et contrairement à la voie intraveineuse, cette concentration maximale est bien plus faible. Cela signifie que l’effet du traitement est réparti dans le temps. En conséquence, la dose injectée peut être augmentée sans risque de toxicité », se réjouit le chercheur.
De nombreux défis attendent désormais l’équipe de l’IGPS. Après des résultats concluants obtenus chez un modèle animal (des souris), il faut désormais se tourner vers des études cliniques chez l’être humain. La start-up Imescia, issue des recherches du laboratoire et récemment créée, a justement pour but de récolter des fonds (à hauteur de 2,5 millions d’euros, selon Julien Nicolas) et de démarrer les premiers essais cliniques en 2024.
Publication
A. Bordat et al. A Polymer Prodrug Strategy to Switch from Intravenous to Subcutaneous Cancer Therapy for Irritant/Vesicant Drugs, J. Am. Chem. Soc., 2022. DOI : https://doi.org/10.1021/jacs.2c04944