À la souche des découvertes
(Article issu de l'Edition n°15 - février 2021)
De nombreuses recherches se consacrent à l’exploration du potentiel régénératif et thérapeutique des cellules souches embryonnaires et pluripotentes induites, et à leur adéquation avec de nouveaux modèles d’étude de maladies. En parallèle, les cellules souches somatiques adultes soignent grands brûlés, déficiences hématopoïétiques et cornée.
Identifiées en 1981 chez la souris, puis chez l’être humain en 1998, les cellules souches embryonnaires (ES) attisent tous les espoirs thérapeutiques. Et pour cause : issues d’un embryon à un stade précoce de son développement, elles affichent des propriétés prometteuses. Potentiellement capables de se multiplier à l’infini, elles sont aussi théoriquement en mesure de donner tous les types cellulaires d’un individu.
En 2006, la première description des cellules souches pluripotentes induites (IPS) génère un nouvel emballement. Produites en laboratoire à partir de cellules somatiques matures d’un individu, ces cellules sont reprogrammées génétiquement pour revenir à un état de cellule souche embryonnaire. Une technique qui permet de s’affranchir d’un certain nombre de problématiques éthiques liées à la manipulation d’embryon.
Assurer le renouvellement de la peau
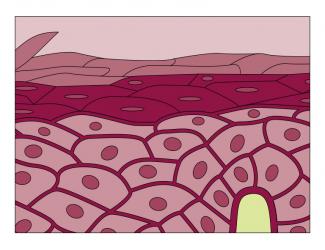
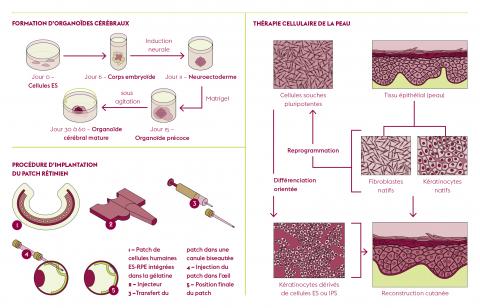
Un champ de recherche s’intéresse aux cellules souches somatiques adultes, naturellement présentes au sein des tissus et organes. Au Laboratoire de génomique et radiobiologie de la kératinopoïèse (LGRK) de l’Institut de biologie François Jacob (UPSaclay, CEA), Michèle Martin et Nicolas Fortunel étudient les cellules souches de l’épiderme humain adulte, qui assurent l’homéostasie du tissu cutané pendant toute la vie de l’individu. Constitué majoritairement de kératinocytes, l’épiderme représente la première barrière de défense de l’organisme et renferme encore de nombreux secrets, dont la localisation précise de ses précurseurs qui n’est pas clairement établie. « Les données cliniques et biologiques montrent que des réservoirs de kératinocytes à très fort potentiel régénératif existent dans la couche basale de l’épiderme interfolliculaire, explique Nicolas Fortunel. Ces cellules restent à ce jour partiellement caractérisées, leur phénotype n’étant pas entièrement établi. »
Pour en isoler des sous-populations très enrichies, l’équipe du LGRK développe une batterie de marqueurs. « On capture alors une situation à un instant donné, qui varie selon la vie de l’épiderme et les stimuli qu’il reçoit. » « Cet état souche, dynamique et transitoire, varie selon le micro-environnement, et se distribue selon des jeux d’équilibre », complète Michèle Martin. Le degré de quiescence (dormance) des cellules en constitue un des meilleurs marqueurs. « Une cellule basale immature très quiescente a de fortes chances d’être dans un état souche. » Sous l’effet d’un stimulus – une blessure par exemple –, cette cellule entre en division, produit des cellules filles qui prolifèrent, certaines se différencient en kératinocytes matures alors que d’autres donnent à nouveau des cellules souches.
Un nouveau phénomène physiopathologique
L’équipe a récemment étudié l’impact d’une irradiation à faible dose, comparable à celle reçue lors d’un scanner, sur la quiescence des cellules souches épithéliales. « On a placé ces cellules dormantes dans le contexte de métabolisme actif de régénération de l’épiderme, qui les a réveillées et poussées à se diviser, relate Nicolas Fortunel. Elles présentent alors une sensibilité exacerbée au stress génotoxique qui, dans une situation normale d’homéostasie du tissu, n’aurait pas d’effets délétères. »
Si, à l’échelle macroscopique, ces cellules souches demeurent capables de régénérer un épiderme tridimensionnel et une différenciation correcte, une désorganisation de l’empilement des kératinocytes apparaît par endroits à l’échelle microscopique. « Ces zones dysplasiques évoquent une transition d’un état épithélial natif vers un état mésenchymateux. Les kératinocytes acquièrent des caractéristiques de fibroblastes. Ce changement phénotypique correspond aux étapes précoces d’une transformation cancéreuse. »
Des milieux de culture à mieux définir
En théorie, les cellules souches épithéliales se gardent des années en culture. « On a calculé qu’avec une seule cellule cultivée dans les meilleures conditions, on pourrait greffer l’humanité entière ! observe Michèle Martin. Mais le plus difficile reste de ne pas abîmer ce potentiel au fur et à mesure des amplifications en culture. »
Jusqu’à récemment, leur culture se faisait dans des milieux pourvus de dérivés d’origine animale, comme du sérum ou des facteurs de croissance, très performants mais peu définis. Les kératinocytes utilisés en clinique sont dans ce cas. Mais les instances réglementaires imposent aujourd’hui aux laboratoires de nouvelles contraintes de recherche, pour aboutir à des milieux bien définis et exempts de protéines animales. « Il y a un besoin aigu de retravailler les conditions d’amplification des cellules souches en culture pour mettre le doigt sur les facteurs absolument nécessaires pour conserver leur potentiel. » « Cela ouvre un nouveau champ de recherche, qui croise biologie moléculaire, génomique et épigénomique », abonde Nicolas Fortunel.
La piste KLF4
C’est d’ailleurs une nouvelle porte d’entrée que l’équipe, en collaboration avec des collègues du CEA de Fontenay-aux-Roses et de l’Institut des cellules souches pour le traitement et l'étude des maladies monogéniques (I-Stem – UPSaclay, Inserm, Univ. d’Évry), vient d’ouvrir : les chercheurs ont montré le rôle du facteur de transcription KLF4 (Kruppel-like factor 4) dans le maintien des kératinocytes humains. En réduisant son niveau d'expression par ARN interférence ou par répression pharmacologique, ils ont favorisé l'immaturité des kératinocytes souches et progéniteurs, et leur auto-renouvellement pendant leur amplification en culture.
L’équipe, qui collabore de longue date avec l’hôpital Percy dédié aux grands brûlés, envisage désormais d’explorer la piste KLF4 dans des modèles précliniques, pour réussir à préserver qualitativement et quantitativement les cellules souches au cours des phases de bio-ingénierie des greffons, et en améliorer le potentiel régénératif. Elle s’oriente également vers de nouvelles classes d’effecteurs de l’épigénome, comme les ARNs non codants. Un champ de recherche encore inexploré dans le cas des cellules souches. « Pour réguler de façon subtile cet état souche, le génome codant ne suffit pas. Nous allons donc chercher du côté de ces ARNs pour tenter d’expliquer la plasticité des cellules souches de l’épiderme et l’équilibre de ce tissu. »
Un patch rétinien de thérapie cellulaire
À l’i-Stem, Christelle Monville et son équipe utilisent la thérapie cellulaire pour soigner la dégénérescence maculaire liée à l'âge (DMLA) et certaines formes de rétinites pigmentaires (RP), caractérisées par une dégénérescence des cellules photoréceptrices de la rétine. Bien qu’il ne soit pas directement impliqué dans la conversion du signal lumineux reçu par l’oeil en un influx électrique transmis au cerveau - réalisée par les photorécepteurs – l'épithélium pigmentaire rétinien (RPE) n’en demeure pas moins essentiel à la vision. Ce feuillet adjacent aux photorécepteurs sécrète des protéines indispensables à leur bon fonctionnement, élimine des déchets ou absorbe les surplus de lumière. Il se trouve également altéré dans la plupart des maladies rétiniennes.
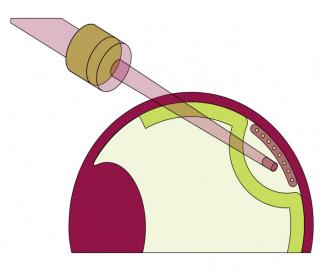
En collaboration avec l’Institut de la vision (Sorbonne Université, Inserm, CNRS), l’équipe a mis au point un patch de cellules RPE issues de cellules souches pluripotentes humaines. « Les cellules RPE sont plus faciles à obtenir – en quantité, fonctionnalité et pureté – à partir de cellules souches pluripotentes que les photorécepteurs, hautement spécifiques et fragiles. Sans compter que la maturation des cellules photoréceptrices continue après la naissance, et que ce processus est difficile à reproduire en culture », rapporte Christelle Monville. L’idée est d’implanter ce patch, de 3 mm de large sur 5 mm de long et en forme de carte SIM, au niveau de la macula de l’oeil, très tôt lors du développement de la maladie, pour préserver la vision centrale en ralentissant ou en stoppant la mort des photorécepteurs.
À l’inverse des protocoles impliquant des cellules en suspension, les cellules RPE sont ici déposées sur une membrane amniotique humaine, obtenue auprès de la banque des tissus de l’hôpital Saint-Louis. « Chez l’animal, on a montré que ce dépôt augmentait les chances d’intégration, de survie et de fonctionnalité des cellules RPE, qui doivent être organisées pour fonctionner correctement. »
Un essai clinique chez l’humain
Après des essais concluants chez des rongeurs et des primates, l’équipe lance à l’automne 2019 un essai clinique de phase 1-2 chez l’être humain, financé par AFM-Téléthon et qui cible 5 % des rétinites pigmentaires. L’essai comprend au total douze patients, répartis dans deux cohortes. Le patch est produit par l’EFS ABG de Nantes durant un mois, et c’est l’hôpital des Quinze-Vingts, à Paris, qui se charge de l’implantation dans l’oeil des patients. Pour cet essai, l’équipe fait également appel à l’entreprise clermontoise Medical Device Engineering, qui conçoit un système de moule en plastique à trois bouchons, pour enrober le patch de gélatine et mieux le manipuler.
À l’issue de la greffe, les patients sont placés sous immunosuppresseurs pendant un an et font l’objet d’un suivi médical très étroit – 14 visites médicales sont prévues durant la première année, puis une tous les six mois durant les quatre suivantes –, avec bilans sanguins, tests visuels et imagerie. « Les deux premiers patients, très mal voyants, ont été greffés en septembre et en octobre 2019. Le but était de tester la sécurité et la tolérance au patch. À ce jour, ils se portent très bien. Ils ont bien supporté leur traitement immunosuppresseur et ne présentent pas de rejet de greffe. Ils ont même décrit un petit bénéfice dans la perception de lumière. » À cause de la crise sanitaire liée au Covid-19 et du premier confinement généralisé au printemps, la greffe des dix patients de la seconde cohorte accuse du retard et les nouvelles implantations démarrent en octobre 2020. Elles s’échelonneront jusqu’à la fin de l’année 2021, voire le début de 2022. « Ces patients sont moins atteints, leur maladie est plus récente. On espère que des photorécepteurs fonctionnels sont encore présents chez eux, pouvoir les sauver et voir un bénéfice fonctionnel de la greffe. »
Aujourd’hui, l’équipe de Christelle Monville s’attaque aux autres 95 % des rétinites pigmentaires, qui impliquent des mutations dans les gènes des photorécepteurs. « On démarre une collaboration avec le Centre de nanosciences et de nanotechnologies (C2N – UPSaclay, CNRS) pour travailler sur des échafaudages plus complexes de patch, avec des photorécepteurs intégrés dans une membrane synthétique en développement au C2N, et reproduire ainsi l’orientation particulière de ces cellules dans la rétine. On va également devoir changer d’échelle, pour produire davantage de patchs en vue d’une mise sur le marché, et travailler sur leur congélation pour les garder plus longtemps. »
De la complexité des maladies neurodégénératives
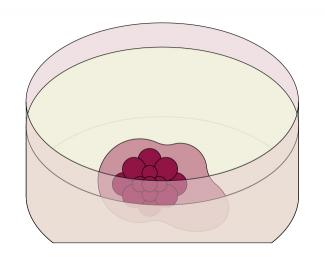
Au Service d'étude des prions et des infections atypiques (SEPIA – UPSaclay, CEA), Jean- Philippe Deslys et Frank Yates, de Sup’Biotech, développent de nouveaux modèles in vitro et en trois dimensions de maladies neurodégénératives. Obtenus à partir de cellules souches pluripotentes induites, issues de la reprogrammation de fibroblastes de peau d’un individu, atteint ou non par une pathologie, ces modèles exploitent l’extraordinaire potentiel d’auto-assemblage des cellules pluripotentes. Après une semaine de culture, ces cellules se différencient en cellules neurales et forment une petite boule appelée corps embryoïde. Puis, en présence d’un hydrogel qui mime l’environnement cellulaire, le corps embryoïde devient en deux mois une sphère de 2-3 mm de diamètre, un organoïde cérébral mature, dont le développement s’arrête systématiquement à un stade fœtal. Sans en posséder tous les types cellulaires – les organoïdes cérébraux ne comportent que des neurones et des cellules gliales – certaines régions de ce « mini-cerveau » s’apparentent à un cerveau humain en développement.
« Quand on s’intéresse à l’évolution, souvent progressive, de maladies ciblant le cerveau humain, les modèles animaux échouent à récapituler l’ensemble des signes physiopathologiques observés chez l’humain », commente Franck Yates. Il faut alors chercher d’autres moyens de disséquer les mécanismes moléculaires sous-jacents, au-delà des modèles en deux dimensions déjà bien caractérisés. C’est là qu’entrent en jeu les organoïdes cérébraux développés par l’équipe du SEPIA et de Sup’Biotech, notamment pour la maladie d’Alzheimer.
Cette maladie se caractérise par une lente dégénérescence neuronale et la formation de lésions dans le cerveau, accompagnées d’agrégats des protéines bêta-amyloïde et Tau. Alors que la forme peptidique Aβ42 de la protéine β-amyloïde s’accumule sous forme de plaques entre les neurones, c’est une forme hyperphosphorylée de la protéine Tau qui s’accumule à l’intérieur des neurones, sous la forme d’enchevêtrements neurofibrillaires. « Mais on ne sait pas si ce sont ces agrégats qui causent la dégénérescence neuronale, ou si c’est la dégénérescence neuronale qui participe à la formation des agrégats », signale Frank Yates. Le problème de l’œuf et de la poule, en somme.
Vers de nouveaux outils
« Avec les organoïdes cérébraux et les techniques d’ingénierie génétique, le laboratoire se dote d’outils capables de récapituler certains signes physiopathologiques de la maladie d’Alzheimer, pour mieux en comprendre les mécanismes », confie Frank Yates. Pour modéliser la pathologie, les chercheurs génèrent, en collaboration avec le laboratoire Croissance, réparation et régénération tissulaires (CRRET – UPEC, CNRS), une forme mutée (p301S) du gène Tau, issue d’un patient atteint d’une démence fronto-temporale. La pathologie, proche de la maladie d’Alzheimer, se caractérise par une phosphorylation de Tau. En forçant l’expression de p301S-Tau dans les organoïdes cérébraux, les chercheurs y induisent cette caractéristique pathologique si importante dans le développement des maladies neurodégénératives.
« Mais essayer de comprendre ce qu’il se passe à l’intérieur d’un organoïde, c’est se confronter à la troisième dimension et ses obstacles techniques », remarque Jean-Philippe Deslys. Pour les contourner, le laboratoire dispose d’un ultramicroscope qui permet d’observer les organoïdes, une fois rendus transparents par un processus chimique. « On vit une époque de révolution technologique, et la combinaison de ces technologies est d’une puissance phénoménale », continue Jean-Philippe Deslys.
En association avec les équipes de François Treussart, du laboratoire Lumière, matière et interfaces (LUMIN – UPSaclay, CNRS, ENS Paris-Saclay, CentraleSupélec), et de Marco- Antonio Mendoza-Parra, du laboratoire Génomique métabolique (UPSaclay, Univ. d’Évry, CNRS, CEA), celle de Jean-Philippe Deslys développe aujourd’hui un projet de recherche transversale centré sur l’étude des phases précoces de la maladie d’Alzheimer grâce aux mini-cerveaux. Financé par la Fondation pour la recherche médicale, le projet comprend la réalisation d’une cartographie 3D de l’expression des gènes impliqués, la production de nanocristaux pour l’enregistrement de phénomènes physiologiques et le suivi de l’activité électrophysiologique des mini-cerveaux, afin de réussir à mieux comprendre ce que soustendent ces agrégats physiopathologiques. « On espère rapprocher notre modèle, initialement embryonnaire, d’un cerveau vieillissant, en forçant les mécanismes aboutissant à l’accumulation des protéines béta-amyloïde et Tau anormales », conclut Frank Yates.
Publications :
- Fortunel NO, Martin MT. When the Search for Stemness Genes Meets the Skin Substitute Bioengineering Field: KLF4 Transcription Factor under the Light. Cells, 9 (10), (2020).
- Karim Ben M'Barek, et al. Clinical-grade production and safe delivery of human ESC derived RPE sheets in primates and rodents, Biomaterials, 230, (2020).
- Nassor Ferid, et al. Long Term Gene Expression in Human Induced Pluripotent Stem Cells and Cerebral Organoids to Model a Neurodegenerative Disease. Frontiers in Cellular Neuroscience, 14, (2020).